Synthetische Biologie zur Herstellung von Sialyllactose


GALAB hat es sich zur Aufgabe gemacht wirtschaftliche und sichere Produktionsverfahren für Humane-Milch-Oligosaccharide (HMO) zu entwickeln, die eine wichtige Rolle in der frühen Entwicklung von Säuglingen spielen. Dadurch möchte GALAB einen Beitrag zur optimalen Ernährung von Säuglingen zu leisten, die nicht gestillt werden können.
Sialylierte HMOs wie Sialyllactose (SL) sind wichtige Bestandteile der Muttermilch und sorgen dafür, dass beim Stillen von Säuglingen Toxine neutralisiert und das Anhaften von Bakterien und Viren an der Epitheloberfläche verhindert wird. Darüber hinaus werden HMOs für die Erforschung von Krankheiten (Infektions-, Autoimmun- und Krebserkrankungen) und für die Anwendung in Arzneimitteln und biologisch funktionalen Materialien benötigt 1-5.
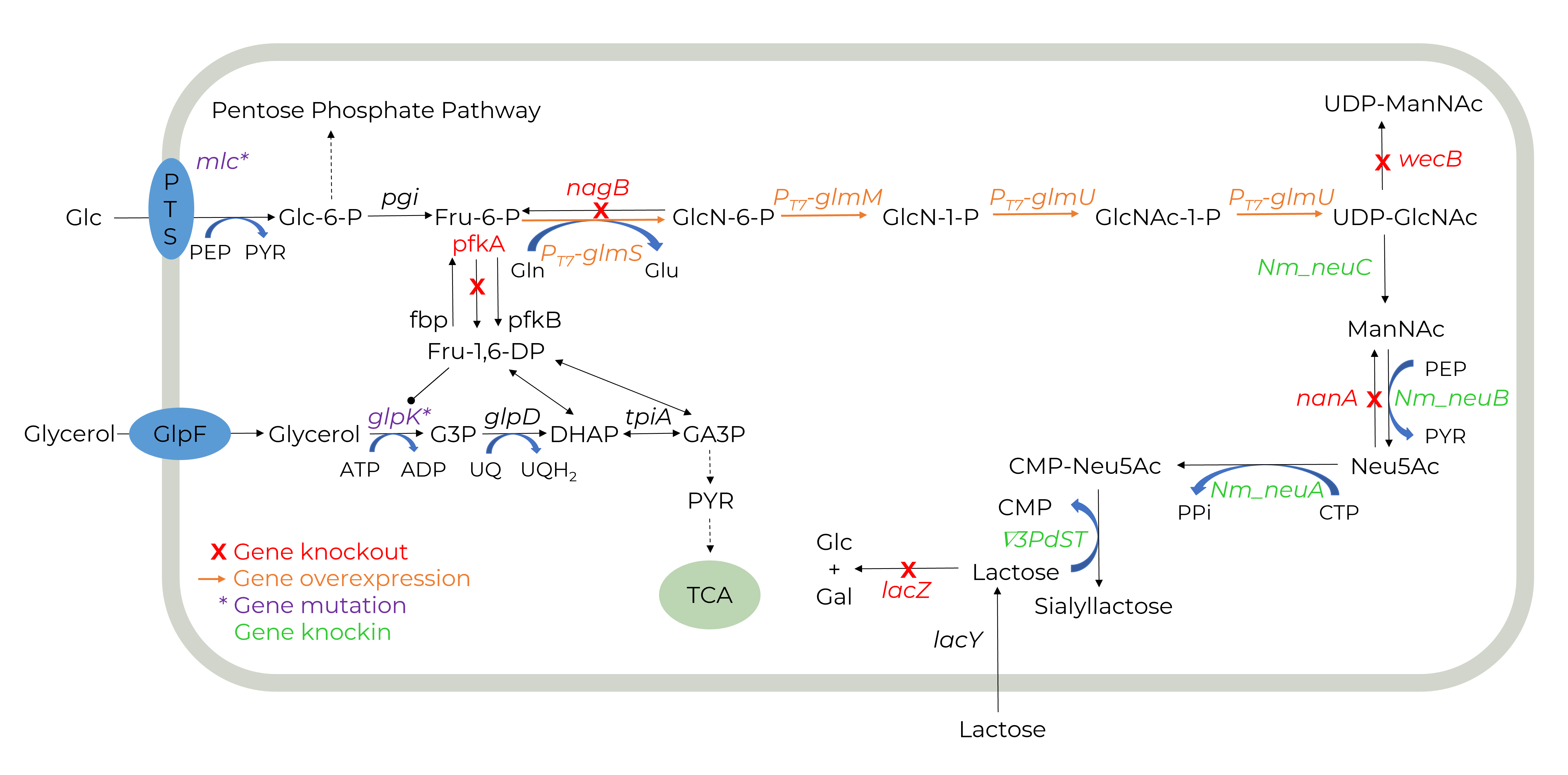
GALAB entwickelt ein biotechnologisches Produktionsverfahren, bei welchem genetisch modifizierte Bakterien in Fermentationsprozessen genutzt werden, um die notwendigen Enzyme für die SL-Produktion zu exprimieren.
Die Verwendung von Ganzzell-Biokatalysatoren in der Herstellung von SL hat mehrere Vorteile. Ganze Zellen sind eine kostengünstige Biokatalysatorform und die Zellwand hat eine natürliche Schutzfunktion für die Enzyme. Darüber hinaus werden teure Cofaktoren zellintern regeneriert, was zu einer Kostenreduzierung führt.
Die größten Herausforderungen bei der Stammentwicklung eines Ganzzell-Biokatalysators für die HMO-Produktion sind der Bedarf an mehreren Enzymen, die Regeneration der Cofaktoren, die Substrataufnahme und Produktfreisetzung sowie die Verhinderung des Abbaus von Zwischenprodukten.
Wir entwickeln den SL produzierenden Stamm mit Hilfe der modernen Genome-Editing-Technik CRISPR-Cas9. Ein weiterer Aspekt, der bei der Stammentwicklung berücksichtigt wird, ist der Transportweg der Substrate und des Produkts in dieZelle, bzw. aus der Zelle heraus, wodurch frühere Limitierungen überwunden werden.
Quellen
1 Z. Li, et al., “Multi-Enzymatic Cascade One-Pot Biosynthesis of 3’-Sialyllactose Using Engineered Escherichia coli,” Molecules, vol. 25, no. 3567, 2020.
2 K. Schmölzer et al., “Complete switch from α-2,3- to α-2,6-regioselectivity in Pasteurella dagmatis β-d-galactoside sialyltransferase by active-site redesign,” Chem. Commun., vol. 51, no. 15, pp. 3083–3086, 2015, doi: 10.1039/C4CC09772F.
3 L. Guo, et al., “Enzymatic Synthesis of 6’-Sialyllactose, a Dominant Sialylated Human Milk Oligosaccharide, by a Novel exo-α-Sialidase from Bacteroides fragilis NCTC9343,” Appl. Environ. Microbiol., vol. 84, no. 13, pp. e00071-18, 2018, doi: 10.1128/AEM.00071-18.
4 L. E. Horsfall, et al., “Identification and characterization of important residues in the catalytic mechanism of CMP-Neu5Ac synthetase from Neisseria meningitidis,” FEBS J., vol. 277, no. 13, pp. 2779–2790, 2010.
5 S. Schelch, et al., “Engineering analysis of multienzyme cascade reactions for 3’-sialyllactose synthesis,” Biotechnol. Bioeng., vol. 118, pp. 4290–4304, 2021, doi: 10.1002/bit.27898.